产品搜索
联系我们
电话:4008750250
手机:18066071954
地址:南京市栖霞区纬地路9号
Email: zhangxiangwen@cobioer.com
技术文章 / article
Nature:绕过Ras激酶“不可成药性”的抗癌新思路
原载自:www.co-bioer.com[技术资料频道] 2016-09-20 浏览次数:2322
Ras-MAPK信号通路的失控发生于多种肿瘤的早期演进过程中,并且也是很多肿瘤抗药性的内在原因。Ras-MAPK信号通路的持续性异常激活常由于K-Ras激酶的突变导致。然而,Ras激酶长期以来被认为是“不可成药”蛋白,即便在体外实验中起作用的药物,一旦到了体内也常常会失效。这严重降低了Ras作为药物靶点的潜力。
在Ras-MAPK信号通路中,K-Ras可稳定RAF信号传导复合物,从而提高RAF激酶的活性。另一方面,假酶的一种——Ras激酶抑制蛋白(KSR)作为一种支架蛋白,通过结合RAF及其底物蛋白MEK激酶,也可稳定RAF信号传导复合物,从而进一步活化Ras-MAPK信号通路。
不过KSR对于Ras-MAPK信号通路的作用不仅仅是激活。当K-Ras由于发生突变而异常活化时,如果KSR也发生突变,部分的KSR突变则会反过来抑制异常活化的突变K-Ras,具备了抑癌的潜力,而不会影响正常的K-Ras。因此,我们是否可能改变KSR的特性,即便在没有发生突变的情况下,使其得以抑制突变的K-Ras,从而间接地为持续异常激活的Ras-MAPK信号通路“降温”,达到抗癌的效果呢?
zui近,西奈山医学院的科学家们就受此启示,开发出了可改变正常KSR特性,使其能够像上述KSR突变体那样靶向抑制突变型K-Ras的小分子化合物。这一成果发表于zui近的《Nature》期刊上。
研究者发现,这些使得KSR具备抑癌能力的突变多发生于该蛋白上的ATP结合区域附近,并推测这些位点可能在KSR结合RAF与MEK激酶的过程中发挥重要角色。在此基础上,他们发现了一类可与ATP竞争结合KSR,并改变其构象的小分子。这些小分子可使KSR倾向于结合MEK,而不再去结合RAF,进而使得KSR在体外细胞系实验中表现出抑制突变K-Ras活性的能力。
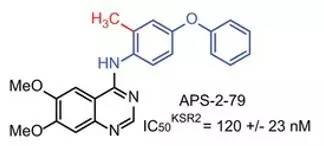
▲APS-2-79结构(图片来源:《Nature》)
APS-2-79是上述小分子中的一个典型代表。结构分析显示,它与KSR的结合可将后者固定在一个非活性的状态,使其无法再结合RAF和激活MEK,从而阻遏了Ras-MAPK信号通路的活动。
体外实验显示,APS-2-79本身并不能抑制带有KRAS突变的癌细胞,但是能够加强MEK抑制剂药物(包括已批准上市的trametinib)对上述细胞的杀伤效果。这显示出APS-2-79与多种Ras-MAPK通路抑制剂联合使用以治疗癌症的潜力。

▲文章通讯作者Arvin C. Dar教授
“KSR属于一个相当大的蛋白质家族,不仅与癌变有关,还涉及到其他很多疾病的发生,”文章通讯作者Arvin C. Dar教授表示:“目前还没有人想到怎样才能充分挖掘这类重要治疗靶点的潜力。我们的研究揭示了调节KSR活性作为一整套全新癌症疗法的可能性。”