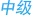产品搜索
联系我们
电话:4008750250
手机:18066071954
地址:南京市栖霞区纬地路9号
Email: zhangxiangwen@cobioer.com
技术文章 / article
5月是黑色素瘤意识月,盘点黑色素瘤研究进展
原载自:www.co-bioer.com[技术资料频道] 2017-05-19 浏览次数:3117
黑色素瘤,又称恶性黑色素瘤,是来源于黑色素细胞的一类恶性肿瘤,常见于皮肤,亦见于黏膜、眼脉络膜等部位。在亚洲人和有色人种中,原发于皮肤的黑色素瘤占50%~70%,zui常见的原发部位为肢端(约占所有黑色素瘤的50%),即足底、足趾、手指末端及甲下等部位,其次为粘膜黑色素瘤(约占20%左右),而欧美白种人这两种亚型仅占所有黑色素瘤的5%。黑色素瘤是皮肤肿瘤中恶性程度zui高的瘤种,容易出现远处转移。早期诊断和治疗因而显得尤为重要。
当黑色素细胞发生恶性转化就会出现黑色素瘤。过度的紫外线照射是明确的黑色素瘤病因之一。紫外线可以损伤皮肤细胞的DNA引起黑色素瘤。如果能够在黑色素瘤细胞离开皮肤进入淋巴结以及身体其他部位之前发现它,病人的五年生存率可以达到91.5%。而如果在比较晚期发现这种癌症,那么病人的五年生存率将只有30%~60%。
大约40%~60%的黑色素瘤存在BRAF蛋白突变。适用于晚期BRAF突变黑色素瘤病人的治疗方法主要归为两大类:靶向治疗,比如化疗,能够阻止癌症生长和扩散;免疫治疗,通过刺激免疫系统攻击肿瘤细胞。
2017年5月是黑色素瘤意识月(Melanoma Awareness Month),其目的在于提高对黑色素瘤的意识,增加早期检测的几率以便较早地进行治疗。基于此,小编针对近期黑色素瘤研究取得的进展进行一番梳理,以飨读者。
1.Nature:黑色素瘤个体化疗法开发取得重大进展!
doi:10.1038/nature22079
尽管基于阻断程序性细胞死亡1受体蛋白(PD-1)的免疫疗法能够成功治疗转移性的黑色素瘤患者,但仍有超过一半的患者并不会通过看到肿瘤萎缩而获得长期的治疗效益,其中一种可能性的原因就是药物并没有在这些患者机体中发挥应有的作用,这些PD-1阻断药物在很多患者机体中缺少一种生物学效应;然而,zui近一项刊登于杂志Nature上的研究报告中,来自宾夕法尼亚大学等机构的研究人员通过研究表明,实际上,大约80%的患者机体中对这些疗法产生反应的T细胞数量都会增加,PD-1靶向抗体pembrolizumab是一种检查点抑制剂药物,其能够有效抑制PD-1受体从而就能够促进T细胞复制并且对癌细胞产生强烈的反应。
但为何促进肿瘤收缩和增加患者机体中T细胞的数量之间存在一定的脱节关系呢?这项研究中研究人员就给出了一定的研究线索;E. John Wherry教授指出,我们发现,患者机体中治疗前肿瘤的尺寸能够确定T细胞对药物产生反应来抑制患者机体肿瘤的强度,肿瘤尺寸越大,药物所激活的T细胞的活化能力就会越强,很多患者经历的临床失败并不仅仅是因为机体免疫系统无法被激活,而且还因为T细胞再度活化的强度和机体原始肿瘤负担失衡所致。
利用pembrolizumab治疗前后IV级黑色素瘤患者机体中外周血的免疫分析结果,研究人员就鉴别出了疗法开始时相比肿瘤尺寸而言循环T细胞所发生的的改变,同时研究者还对47名患者机体的血液改变进行了研究,这些参数之间的关系或许能够帮助深入阐明患者机体对免疫疗法的反应。Jedd Wolchok博士表示,这项研究能够帮助回答一些关键的问题,即为何某些患者对抗PD-1抑制剂疗法并无反应而为何有些患者却能够产生反应,我们想通过研究理解利用抗PD-1抗体疗法治疗患者时其机体免疫系统所发生的变化,同时对这些患者机体中发生的免疫学变化进行定性研究。
当黑色素瘤患者对PD-1阻断剂没有反应时,并不*是出于同样的原因,但将免疫反应重新激活机体同肿瘤负担进行时,研究者提出了检查点抑制剂疗法失败的三种原因,即这种疗法并不能有效促进机体免疫反应再度激活,相比肿瘤尺寸而言免疫效应不充足或者药物发生了脱靶。Wherry说道,这项研究中我们鉴别出了多种疗法失败的情况,这对于后期开发新一代治疗措施非常关键。
研究者表示,当新型疗法使用后3-6周,他们将会利用这种方法来检测其它患者是否会因这种药物而获益,在PD-1临床试验中,其相比正常12周的重点疗法要早6周,如果患者并不会因pembrolizumab而获益,临床医生就会采用其它类型的药物来放大患者机体对*种药物的免疫响应,他们会将额外疗法同PD-1阻断剂疗法失败的类型相匹配来对患者进行治疗。
2.PCMR:利用新方法培养出用于黑色素瘤研究的小鼠细胞系
doi:10.1111/pcmr.12220
在一项新的研究中,来自美国达特茅斯大学盖泽尔医学院(Dartmouth Geisel School of Medicine)的研究人员开发出一种允许从小鼠黑色素瘤中收集的细胞在体外细胞培养中容易生长的方法,并且利用这种方法培养出多种对PLX4032敏感的小鼠BRafV600E黑色素瘤细胞系。相关研究结果近期发表在Pigment Cell & Melanoma Research期刊上,论文标题为“Multiple murine BRafV600E melanoma cell lines with sensitivity to PLX4032”。
鉴于一般的小鼠细胞系缺乏在人黑色素瘤中经常普遍存在的这种BRAF突变,并且这些细胞系在体外培养时生长缓慢,因此它们不能代表人黑色素瘤细胞系。对控制小鼠细胞系行为的分子机制进行详细研究一直存在困难,这是因为当前可获得的小鼠细胞系在体外培养中不能很好地生长。
在这项研究中,研究人员是开发出一种允许从小鼠肿瘤中收集到的黑色素瘤细胞在体外细胞培养时容易生长的方法。重要的是,这些细胞系与免疫功能完好的小鼠品种在遗传上是匹配的,而不像人细胞需要被植入到免疫功能受到削弱的小鼠体内才能生长。因此,能够在体外细胞培养物中和具有完整免疫系统的小鼠体内研究这些小鼠黑色素瘤细胞系是实验上的一大优势。
3.纳米颗粒携带药物组合可治疗黑色素瘤
doi:10.1158/1535-7163.MCT-16-0285

来自美国的研究人员开发了一类新型药物,可以借助纳米颗粒对一种药物组合进行运输这样可以避免黑色素瘤产生治疗抵抗。这种叫做CelePlum-777的药物包含了一定比例的抗炎药物Celecoxib和毒性药物Plumbagin,通过这两种药物的结合,细胞很难产生抵抗。
Celecoxib和Plumbagin以特定比例联合使用能够协同杀死黑色素瘤细胞。研究人员借助纳米颗粒将药物直接送达癌细胞,“将多种药物装载到纳米颗粒中是一个创新方法,可以将多种癌症药物同时送达需要它们发挥作用的部位。另外一个优势就是通过药物联合,可以使用更为有效且毒性更小的药物浓度。”领导该研究的Raghavendra Gowda教授这样说道。
Celecoxib和Plumbagin无法通过口服的方式很好地进入体内,因此不能达到发挥毒性杀伤作用所需的药物比例。CelePlum-777可以通过静脉注射的方式注入体内,因为药物尺寸小可以在肿瘤内部积累随后释放药物杀死癌细胞。研究人员在学术期刊Molecular Cancer Therapeutics 和 Cancer Letters上报道了他们的结果。
研究人员在肿瘤细胞系和肿瘤小鼠模型上检测了CelePlum-777对癌细胞的杀伤作用。这种新型药物能够阻止小鼠体内的肿瘤发育,并且没有显著副作用。在这种药物进入临床试验阶段之前,还需要进行更多的临床前研究。目前该药物已申请并授权给Cipher Pharmaceuticals公司,未来将由该公司继续进行FDA所要求的各种检测。
4.CCR:抗衰老基因或可成为治疗黑色素瘤的新靶点
doi:10.1158/1078-0432.CCR-17-0201
Wistar研究所的科学家们发现一种抗糖尿病药物可以通过激活一个抗衰老基因进而抑制一个参与转移进展和抵抗靶向治疗的蛋白来抑制老年黑色素瘤病人体内黑色素瘤的生长。相关研究结果在线发表在学术期刊Clinical Cancer Research上。
Wistar的科学家们曾经发现肿瘤微环境存在一些衰老相关的变化,这些改变会驱动黑色素瘤进展和治疗抵抗。他们还发现Wnt这种蛋白能够促进肿瘤细胞的转移以及对治疗药物的抵抗和不良预后,Klotho是可以调节Wnt的一种抗衰老蛋白。
在这项新研究中研究人员用一种促进Klotho表达降低Wnt水平的药物处理小鼠,发现这种药物可以抑制老年小鼠体内已经产生治疗抵抗的黑色素瘤的生长,但是在年轻小鼠身上并没有这种效果。
该研究团队使用了一种人造皮肤模型来重新建立黑色素瘤细胞与年轻或衰老的肿瘤微环境之间的。他们观察到Klotho,Wnt,黑色素瘤细胞以及肿瘤微环境之间存在错综复杂的相互调控关系。他们还发现利用抗糖尿病药物罗格列酮可以改变Klotho表达进而降低Wnt的表达水平。重要的是,罗格列酮联合靶向治疗药物可以共同抑制年轻和老年小鼠体内的肿瘤生长,单独使用罗格列酮反而会促进年轻小鼠体内的肿瘤生长而抑制老年小鼠体内肿瘤的生长。
5.PCMR:新研究为黑色素瘤治疗提供潜在靶点
doi:10.1111/pcmr.12579

一旦肿瘤消耗完原发灶所有的氧气和营养成分就会向身体其他部位发生转移寻找更多营养供给。来自美国NIH的研究人员对HIF1a进行了新的研究,该分子在许多种癌症中发挥氧气和营养成分感受器的作用。他们发现了40个新基因能够被 HIF1a开启或关闭,10个基因与黑色素瘤从原发灶向身体其他部位转移所需要的时间有关。他们将研究成果发表在学术期刊 Pigment Cell and Melanoma Research 上。
“这些在原发黑色素瘤中新发现的基因和信号通路可以帮助研究人员开发治疗所需要的新靶点,还可能用于其他癌症的治疗,”文章作者Stacie Loftus 博士这样说道。“除此之外,基因表达的变化(开启或关闭)还可以在未来用于预测癌细胞如何以及何时发生扩散,以及肿瘤的生长速度。”
6.EBioMedicine:科学家或有望开发出抵御黑色素瘤扩散的新疗法
doi:10.1016/j.ebiom.2017.01.013
日前,来自牛津大学等机构的研究人员通过研究鉴别出了黑色素瘤细胞扩散的新方法,相关研究刊登于Ebiomedicine上,该研究或能帮助科学家们开发新型疗法来关闭黑色素瘤细胞中的侵袭性基因,从而实现对黑色素瘤的抑制。
本文研究中研究人员鉴别出了一种新型的可用作靶向药物开发的靶点,通过抑制细胞切换到侵袭性行为的过程或许就能够有效抑制黑色素瘤以及其它转移性癌症的扩散。研究者Smith解释了两种类型的行为,同时他还指出,这些行为的主要特点表现为两种不同的调节性因子MITF(增殖细胞)和BRN2(侵袭性细胞)会进行表达。BRN2能够降低MITF的表达从而减缓细胞增殖,但同时会使得细胞处于一种侵袭性的模式。
同时研究人员还鉴别出了一种能让BRN2发生上述作用的新型途径,首先该途径会增加另外一种名为NFIB的调节性因子进行表达,从而就能够控制细胞的侵袭性程序;而NFIB的一个重要靶点就是名为EZH2的酶类,该酶能够对细胞活性产生全面性的改变,同时其还会促进侵袭性基因的表达并且关闭MITF进而抑制细胞发生增殖,这样就会增强肿瘤细胞的侵袭性能力。
研究人员认为,一旦细胞离开肿瘤位点其就不再能够接受信号来诱发开关开启,因此机体系统就会重置MITF驱动的细胞增殖状态,从而就能够促进新发肿瘤在新的位点中形成并且增殖。zui后研究者表示,我们发现NFIB-EZH2途径或许能够支撑其它类型癌症以及肺癌的转移,好消息就是目前在临床试验中有特殊药物能够化学性地抑制EZH2,从而就能够有效阻断癌症的侵袭。
7.Mol Cancer Therap:新型药物或能有效阻断90%的黑色素瘤转移
doi:10.1158/1535-7163.MCT-16-0482

日前,刊登在杂志Molecular Cancer Therapeutics上的一项研究报告中,来自密歇根州立大学的研究人员通过研究发现,一种新型的潜在药物或能降低高达90%的黑色素瘤细胞的扩散。这种人工小分子化合物能够对黑色素肿瘤细胞中产生RNA分子和特定蛋白质的基因的活性进行靶向作用,特殊的基因活性(或转录过程)能够诱发黑色素瘤扩散,但研究者开发的新型化合物能够有效对其进行抑制,截止到目前为止,很少有药物化合物能够达到这种目的。
研究者指出,这种新型化合物能够阻断黑色素瘤细胞中一种名为心肌素相关转录因子(MRTFs)的蛋白开启基因转录过程,而这些触发蛋白又能够被另一种名为RhoC(Ras同源性C)的蛋白所开启,RhoC蛋白存在于信号通路中,其能够促进疾病在机体中快速扩散。这种新型化合物能够降低85%至90%的黑色素瘤的转移,同时研究者还发现,这种潜在的药物还能够明显降低注射人类黑色素瘤细胞的小鼠肺部中肿瘤的转移。
研究者Neubig表示,我们利用完整的黑色素瘤细胞来对化学抑制剂进行筛选,这或许就能够帮助我们找到有效阻断RhoC通路的化合物。而阻断整个通路就能够帮助研究人员发现MRTF信号蛋白可以用作新型的药物靶点。阐明这种通路在哪些患者机体中处于开启状态对于后期开发新型化合物非常关键,因为这或许能够帮助研究者确定哪些病人zui能够因摄入药物而获益,当上述通路处于开启状态,新型化合物就能够有效关闭黑色素瘤细胞的生长,并且抑制疾病进展,因此MRTF蛋白的激活或许就能够作为一种新型标志物来帮助确定患者出现黑色素瘤的风险。
8.科学家开发自动化技术可在早期阶段检测黑色素瘤
doi:10.1111/exd.13250
即使是zui牛的专家也有可能被黑色素瘤愚弄。患上这种皮肤癌的病人经常会在皮肤上长出一些看起来像痣的东西但是形状和颜色可能不规则,很难与良性的痣进行区分,因此黑色素瘤的诊断非常困难。现在来自美国洛克菲勒大学的研究人员开发出一种自动化技术,结合影像检查与数字分析以及机器学习帮助医生在早期阶段检测病人的黑色素瘤。
在这个新方法中,病变的图片会经过一系列计算机程序的处理,从中提取颜色数目以及其他可定量数据。这种分析方法会产生一个整体的风险指数,叫做Q指数,代表着发生癌变的可能性。
zui近发表在Experimental Dermatology上的一项研究对这种方法的可用性进行了评估,研究表明Q指数在发现早期黑色素瘤方面的正确率很高。对正常痣的正确检测率为36%,接近皮肤病专家在显微镜下对可疑痣的直观检测。
研究人员在开发该工具的过程中使用了60张黑色素瘤的图片和等量的良性生长物图片,用图像处理程序进行分析。他们开发了图像标记物来准确定量生长物的视觉特征,再利用计算机软件产生一系列可定量指标来区分两组图片。
通过将数据与每一种标志物进行结合,他们为每张图片计算出一个Q指数,介于0和1之间,数字越大代表癌变的可能性越大。
9.强大的肠道菌群!竟然影响黑色素瘤病人对免疫治疗药物的应答
新闻来源:Gut microbes linked to immunotherapy response in melanoma patients
在利物浦举办的国家癌症研究所(NCRI)癌症会议上,德克萨斯大学安德森癌症中心的科学家介绍了他们的一项发现:对于癌细胞已经扩散的恶性黑色素瘤病人来说,如果他们的肠道细菌多样性更加丰富,他们对免疫治疗产生应答的可能性会更大。
参与该研究的科学家们共分析了超过200张嘴和100份肠道菌群样本,这些样本都来自晚期黑色素瘤患者。他们发现对免疫治疗产生应答的癌症病人其肠道中的细菌多样性也更加丰富,他们还发现了在应答者和不应答者之间存在显著差异的细菌类型。病人的口腔细菌类型并没有差异。
这项研究表明在进行免疫治疗之前通过给予抗生素,益生菌或者粪便移植改变肠道菌群能够增加免疫治疗药物的效果,这些新药目前已经用于治疗几种不同类型的癌症。但是这还需要进行更进一步的临床试验验证。
10.治疗黑色素瘤该选择靶向治疗还是免疫治疗?这项研究给你一个答案
doi:10.1001/jamaoncol.2016.4877
大约40%~60%的黑色素瘤存在BRAF蛋白突变。来自加拿大麦克马斯特大学的研究人员zui近发现,对于晚期黑色素瘤病人来说,联合使用几种免疫治疗方法能够提高病人生存率,降低危及生命的事件的发生风险。相关研究结果发表在学术期刊JAMA Oncology上。
适用于晚期BRAF突变黑色素瘤病人的治疗方法主要归为两大类:靶向治疗,比如化疗,能够阻止癌症生长和扩散;免疫治疗,通过刺激免疫系统攻击肿瘤细胞。但哪种才是*的初始治疗方法仍然不清楚。这项研究的目的就是评估不同的系统治疗方法对诊断为晚期BRAF突变黑色素瘤但尚未接受任何治疗的病人的治疗效率和安全性。
研究人员分析了2011年到2015年之间发表的15项随机对照试验数据,其中共包含6662名癌症病人,这些病人或者是体内的癌细胞已经扩散到淋巴结不适合手术,或者黑色素瘤已经发生远端转移。研究人员评估了靶向治疗或免疫检查点抑制剂为这些病人带来的好处和坏处。他们发现BRAF和MEK联合靶向治疗以及PD-1免疫治疗对于改善整体生存率同样有效。BRAF和MEK联合抑制对于提高无进展生存率zui有效。PD-1抑制剂与显著降低危及生命事件的风险有关。
11.Cancer Res:添加一味神奇“佐料” 改善T细胞治疗黑色素瘤效果
doi:10.1158/0008-5472.CAN-16-0587
来自美国南卡罗莱纳医科大学和芝加哥洛约拉大学的研究人员合作证明利用N-乙酰半胱氨酸(NAC)培养用于免疫治疗用途的T细胞能够提高T细胞在黑色素瘤临床前模型中的治疗效率和结果。相关研究结果发表在学术期刊Cancer Research上。
临床试验数据显示,高达40%的IV期黑色素瘤病人接受过继T细胞治疗后(adoptive cell therapy,ACT)可存活5年。ACT这种方法主要通过促进病人自身免疫应答对抗癌症从而发挥作用。为了实现这一点,需要收集病人自身T细胞通过基因修饰方法表达处于激活状态的T细胞受体,然后再快速扩增获得大量用于治疗重注的T细胞。
不过病人对这种治疗方法的应答情况不尽相同。注入体内的细胞持续时间越长治疗效果越好,但是T细胞在体外的快速扩增会导致T细胞对激活诱导的细胞死亡(AICD)变得更加易感,因此研究人员认为AICD会降低ACT疗法的整体效果。
研究人员发现在T细胞体外培养条件中添加NAC能够防止DNA损伤标记物γH2AX的增加,还可以显著促进T细胞的存活时间和免疫治疗结果,包括抑制肿瘤生长,改善生存情况。
研究发现接近40%利用NAC培养的T细胞可以在肿瘤中被检测到,相比之下标准方法培养的T细胞只有大约1.2%能够在肿瘤中被检测到。研究人员还发现接受NAC培养T细胞治疗的小鼠其肿瘤生长得到了显著抑制。
将NAC加入到现有的培养流程中几乎不会对病人造成任何危险,NAC已经在临床上得到许多应用,并且利用NAC培养T细胞的过程也是在病人体外进行。