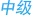产品搜索
联系我们
电话:4008750250
手机:18066071954
地址:南京市栖霞区纬地路9号
Email: zhangxiangwen@cobioer.com
技术文章 / article
HRD检测之我见---科佰生物
原载自:www.co-bioer.com[技术资料频道] 2020-12-11 浏览次数:3628
背景
DNA同源重组修复(HRR)是DNA双链损伤的重要修复方式。HRR是一条涉及到多个步骤的复杂的信号通路,其中关键蛋白为BRCA1和BRCA2。如果BRCA基因出现突变导致BRCA1和BRCA2蛋白失去功能,就会引起HRD。目前已证实HRD可致“基因组疤痕”现象,包括基因组杂合性缺失,端粒等位基因失衡和大片段迁移等。
从作用机理而言,有HRD的肿瘤细胞对铂类药物或PARP抑制剂更敏感。在卵巢癌中,BRCA基因突变、HRR基因的突变、基因启动子甲基化以及其他原因均可以导致HRD。由此可见,如果只检测BRCA基因突变,会导致一部分HRD阳性患者错失PARP抑制剂维持治疗的机会,HRD检测可能为BRCA阴性的患者提供获益的机会。HRD阳性才是选择应用PARP抑制剂维持治疗的合理生物标记物。
2018年4月美国FDA批准Rubraca®(rucaparib)片剂用于复发性卵巢上皮癌、输卵管癌或原发性腹膜癌患者的维持治疗,这些患者接受铂类化疗后有*或部分缓解。FDA还同时批准了补充诊断测试FoundationFocus CDx BRCA LOH用于确定肿瘤样本的同源重组缺陷(HRD)状态,并将Rubraca单药治疗BRCA突变(生殖系和/或体细胞)的晚期卵巢癌从加速批准转为正式批准。对应的技术文件,请点击下载。
2019年10月美国FDA批准尼拉帕利(Niraparib,Zejula)用于治疗已接受过 ≥3种 化疗方案的晚期卵巢癌,输卵管癌或原发性腹膜癌患者,并且这些癌症均为同源重组缺陷症(HRD)阳性。同时,FDA 还批准 Myriad myChoice CDx test 作为作为鉴定有资格使用尼拉帕利(Niraparib)的伴随诊断方法(Niraparib 的使用必须基于FDA批准的伴随诊断)。对应的技术文件,请点击下载。